Хромирование металла в домашних условиях своими руками. Подготовка к процессу хромирования
Хромирование металла в домашних условиях своими руками. Подготовка к процессу хромирования
Если Вы решили осуществить химическое хромирование самостоятельно, следует знать, что нужно для этого процесса.
Прежде всего, необходимо:
- Выбрать помещение, в котором будут проводиться работы по хромированию. Дело в том, что при этой процедуре в воздух выделяется множество вредных испарения, которые при большой концентрации и плохом проветривании могут повредить дыхательные пути. Кроме того, они могут оседать на мебели и других изделиях и разрушать их. Поэтому, для этих целей следует выбрать гаражное, сарайное помещение или мастерскую с хорошей принудительной вентиляцией.
- Для хромирования в домашних условиях нужно предусмотреть наличие защитных средств – респиратора, специальных очков, прорезиненных перчаток, фартука.
- Позаботиться о том, куда деть отходы хромирования, поскольку из-за наличия в них кислот и химических соединений смывать в канализацию или выливать в водосточную трубу их нельзя.
- Подготовить все необходимое оборудование для хромирования в домашних условиях.
Так называемая гальваническая ванна состоит из:
- Емкости, которая устойчива к воздействию кислот. Она может быть выполнена из стекла, пластика, пропилена, полиэтилена. Размер зависит от величины изделия. К примеру, для хромирования часов в домашних условиях подойдет небольшая мисочка, а для дисков понадобится емкость побольше.
- Источника питания с общей мощностью не более одного киловатта. Для мелких деталей, к примеру, для хромирования фар в домашних условиях, можно пользоваться стабилизатором постоянного тока.
- Нагревательного устройства для электролита. К примеру, ТЭН, имеющий защиту от воздействия кислот (керамический).
- Обычного термометра с диапазоном сто градусов по Цельсию.
Хромирование деталей в домашних условиях происходит со специальным электролитом, набор компонентов для которого нужно приобрести – дистиллированную воду, ангидрид хрома, концентрированную серную кислоту.
Гальваника своими руками в домашних условиях. Особенности процесса
Гальваника, в том числе в домашних условиях, очень похожа на электролиз (где используется электричество для разделения химического раствора), что является обратной процедурой, при которой батареи производят электрические токи.
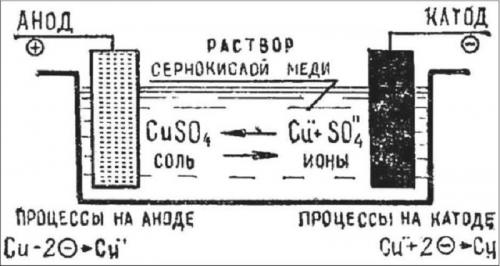
Схема электролиза
Необходимо использовать для гальваники в домашних условиях правильные электроды и электролитный раствор, предопределив химическую реакцию или реакции, которые будут протекать, когда электрический ток начнет действие. Атомы, которые присоединяются к изделию, поступают из электролита. Поэтому, если происходит процесс гальваники для покрытия из меди вам нужен медный электролит, а для золотого покрытия вам необходим электролит на основе золота.
Мастеру во время гальваники необходимо убедиться, что изделие, которое будет использоваться, полностью чистое. В противном случае, когда на него будут поступать атомы из электролита, они не образуют хорошей связи, и элементы могут просто выпасть в осадок. Как правило, очистка проводится путем погружения электрода в сильный кислотный или щелочной раствор, или путем (короткого) подключения цепи гальванопокрытия в обратном направлении. Если электрод действительно чист, атомы от металлизации соединяются в очень сильную кристаллическую структуру.

Обработанные золочением предметы
Гальваника выполняемая в домашних условиях включает пропускание электрического тока через электролит. Это делается путем погружения в электролит двух клемм, называемых электродами, и подключения их к цепи с батареей или другим источником питания. Электроды и электролит изготавливаются из тщательно отобранных элементов или соединений. Когда электричество протекает через контур, электролит расщепляется, и некоторые из атомов материала, которые он содержит, осаждаются в тонком слое поверх одного из электродов. Таким образом, реализуется гальванопластика дома Все виды металлов могут быть покрыты таким образом, включая золото, серебро, олово, цинк, меди, кадмия, хрома, никеля, платины и свинца.
Чтобы получить ровное гальваническое покрытие, мастер должен сначала очистить поверхность вашего металлического предмета и подготовить необходимое оборудование. Грязь и масла на поверхности могут помешать донорскому элементу покрывать поверхность. Начните с обезжиривания, моющим средством (мыло для посуды), а затем протрите металл абразивным кислотным очистителем, чтобы поверхность была очень чистой.
Хромирование изделий. Что такое хром?
Хром - серебристо-белый металл с синеватым оттенком. Он обладает высокой твердостью и хорошо сопротивляется механическому износу.
Хром принадлежит к числу электроотрицательных металлов, его стандартный электродный потенциал E0(Cr0/Cr3+) равен -0,74В. В атмосферных условиях хром сохраняет цвет и блеск длительное время, что объясняется образованием на его поверхности тонкой, но очень прочной оксидной пленки. Высокой склонностью к пассивации и наличием этой пленки объясняется значительная коррозионная стойкость хромовых покрытий. В окислительных средах хром пассивируется легче, чем на воздухе и его потенциал сдвигается от стандартного в анодную область до +0,2В. Стационарный электродный потенциал хрома положительнее, чем у железа. Поэтому хромовые покрытия по отношению к стальным изделиям являются катодом.
Хром устойчив во влажной атмосфере, в атмосфере сероводорода и сернистого газа, в растворах серной, азотной, фосфорной и органических кислот, щелочей. В растворах соляной кислоты и горячей концентрированной серной хром растворяется из-за разрушения оксидной пленки.
Хромирование - процесс нанесения на поверхность изделия тонкого слоя металлического хрома для придания требуемых характеристик. Если говорить о гальваническом хромировании, осаждение металла происходит из электролита под действием электрического тока.
Хромовые покрытия широко применяются для придания изделию исключительной износо- и жаростойкости, а также для уменьшения коэффициента трения. Часто используются для придания высокодекоративного внешнего вида.
Обозначение | |
Толщина (оптимальная, возможно осадить больше) | |
Температура плавления | 1850-1900оС. |
В соединениях хром чаще всего трехвалентен и шестивалентен. Соединения шестивалентного хрома являются сильными окислителями. Хромовый ангидрид при растворении в воде образует смесь хромовых кислот HCrOи HCrO. Именно из них чаще всего и производят хромирование деталей.
- 42-;
Электрохимический эквивалент хрома в хромовой кислоте составляет 0,323 г/А*ч. Но, так как выход по току металла в таких электролитах часто не превышает 10-12 %, то фактически за 1 А*ч выделяется 0,032-0,038 г хрома, т.е. в 30 раз меньше, чем никеля, в 37 раз меньше, чем меди, в 125 раз меньше, чем серебра. Единственной возможностью некоторой компенсации этого недостатка является повышение плотности тока.
В растворах трехвалентного хрома электрохимический эквивалент хрома вдвое больше, выход по току - в 4-5 раз больше, чем в хромовой кислоте.
Многочисленные попытки использовать для промышленного применения электролиты на основе трехвалентных соединений, однако, не нашли успеха, особенно для осаждения толстых износостойких покрытий.
Далее будут рассмотрены только растворы на основе шестивалентного хрома.
Электрохимическое осаждение хрома существенно отличается от других гальванических процессов:
- В большинстве электролитов, применяемых в гальванотехнике, основным компонентом является соль осаждаемого металла. При хромировании главным компонентом является хромовая кислота.
- В хромовом электролите должны присутствовать в определенном соотношении посторонние анионы: SO42-, F-или SiF62-.
- Минимальная плотность тока, при которой начинается выделение хрома, в несколько сот раз выше, чем в других процессах электроосаждения металлов.
- Электроосаждение хрома более чувствительно к изменению температуры и плотности тока по сравнению с другими гальваническими процессами. Изменение этих параметров оказывает существенное влияние не только на количественные показатели (выход по току и др.), но и на структуру и свойства осадков хрома.
- В отличие от других процессов электроосаждения металлов выход по току при хромировании резко снижается по мере повышения температуры.
Итак, основными особенностями процесса хромирования являются высокий отрицательный потенциал восстановления дихромат-анионов, низкий выход металла по току, высокие рабочие плотности тока и очень низкая рассеивающая способность электролита.